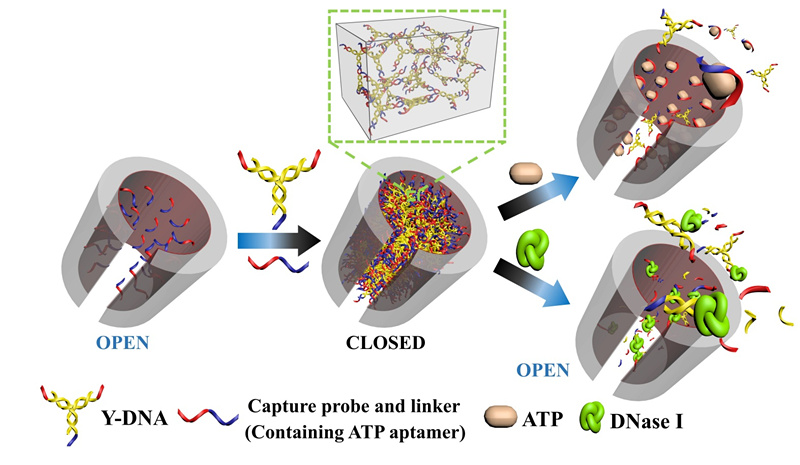
3月25日,雷电竞RAYBET官网夏帆教授课题组在《先进材料》(Advanced Materials)上正式发表论文“‘3D’结构DNA门控作用仿生纳米孔道的研究”(Adv. Mater.,2015,27,2090–2095)。这标志着该课题组在生物纳米材料领域取得了阶段性研究成果。
夏帆教授课题组通过碱基互补配对作用对DNA序列的设计,构筑了一种新型的高密度交联“3D”结构DNA,将这种结构的DNA序列在纳米孔道体系中进行自组装。由于“3D” 结构DNA中有n+1黏性末端,弥补了纳米孔道内组装时,简单结构的核酸探针所存在的非垂直角度生长、容易倒伏和黏性末端易被“终止”等缺点。 这种“3D”结构DNA在不同孔径(30 nm -650 nm),尤其是在比较大孔径的孔道里具有非常好的门控性质。在 270 nm 到 650 nm 范围内,开关比维持在103-105 。该体系能够在不同分子(小分子ATP和蛋白质DNA酶)的刺激下,完成相应的开关过程。开关过程的时间,可以通过在体系中加入稀释的有机试剂(乙醇)起到加速作用。这种由DNA控制的高性能纳米流体门控体系将在生物分析和高信噪比智能纳米器件的构筑方面具有巨大的应用价值。
据介绍,自2012年起,夏帆教授课题组即开始了生命分子(核酸)在纳米限域空间内的相互作用研究。通过对固体纳米孔道进行含有ATP适配体的特殊核酸探针修饰,构筑了高效智能的纳流体门控体系(J. Am. Chem. Soc. 2012, 134, 15395− 15401)。
2013年,夏帆教授课题组通过在人工固体纳米孔道内修饰可以自组装形成超级大夹心结构的核酸探针,构筑了纳米孔传感检测平台。实现了在同一个体系中对目标探针和小分子(ATP)进行高选择高灵敏的双检测功能,小分子的检测限分别为10 fM和 1 nM。并且,这种检测可以在多组分混合物和复杂生物样本中依然有很好的检测能力(Angew. Chem. Int. Ed. 2013, 52, 2007–2011)。